Εδάφια:
6.a.
Μόρια και μοριακοί δεσμοί
6.b.
Κβαντομηχανική περιγραφή του χημικού δεσμού
6.c.
Περιστροφή και ταλάντωση μορίων
6.d.
Μοριακά φάσματα
Μόριο ονομάζουμε ένα σύνολο ατόμων που είναι ενωμένα με χημικούς δεσμούς. Τα μόρια υπάρχουν στη φύση γιατί είναι ενεργειακά συμφερότερες καταστάσεις από ό,τι τα μεμονωμένα άτομά τους.
Οι ιδιότητες του κάθε μορίου εξαρτώνται από τα άτομα που το αποτελούν και από το είδος των δεσμών μεταξύ τους. Οι δεσμοί αυτοί, όπως θα γίνει φανερό στη συνέχεια, οφείλονται στα εξωτερικά ηλεκτρόνια, τα οποία ονομάζονται και ηλεκτρόνια σθένους (υπεύθυνα για το "σθενος" των ατόμων στο να σχηματίζουν δεσμούς).
Οι δεσμοί ανάμεσα στα άτομα του μορίου οφείλονται σε ηλεκτροστατικές δυνάμεις μεταξύ των ατόμων αυτών. Οι δυνάμεις αυτές είναι συνδυασμός απωστικών και ελκτικών δυνάμεων (λόγω άπωσης των ομώνυμων φορτίων και έλξης των ετερώνυμων φορτίων των ατόμων). Το δυναμικό σε ένα διατομικό μόριο, ως συνάρτηση της απόστασης των πυρήνων, μπορεί να προσεγγιστεί από την έκφραση
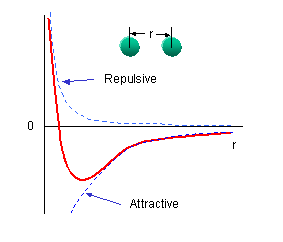
Το δυναμικό U είναι αρνητικό (ελκτικό) ή θετικό (απωστικό) ανάλογα με την απόσταση ανάμεσα στα άτομα. Η θέση ισορροπίας του μορίου (απόσταση ισορροπίας των ατόμων του) είναι στο ελάχιστο του δυναμικού (τότε η συνολική δύναμη (=παράγωγος του δυναμικού) είναι μηδέν). Παρατηρήστε την ομοιότητα του μοριακού δυναμικού κοντά στο ελάχιστό του με το δυναμικό αρμονικού ταλαντωτή.
Η λεπτομερής περιγραφή των δεσμών (μηχανισμών σύνδεσης) των ατόμων για το σχηματισμό μορίου είναι πολύπλοκο πρόβλημα που εμπεριέχει αλληλεπιδράσεις πολλών σωματιδίων. Μπορούμε παρ' όλα αυτά να περιγράψουμε τους δεσμούς χρησιμοποιώντας μερικά απλοποιημένα μοντέλα, που αναπαράγουν αρκετά ικανοποιητικά τα βασικά χαρ/κά των διαφόρων ειδών δεσμού. Οι μοριακοί δεσμοί μπορούν να καταταγούν σε μια από τις παρακάτω κατηγορίες:
Παράδειγμα ιοντικού δεσμού έχουμε στο NaCl, για το σχηματισμό του οποίου το τελευταίο ηλεκτρόνιο του Na (Ζ=11) (σε ποια στοιβάδα βρίσκεται;) συλλαμβάνεται από το Cl (Ζ=17), συμπληρώνοντας την τελευταία ημικατειλημμένη στάθμη του. Η απόσταση ισορροπίας (απόσταση πυρήνων) του μορίου του NaCl είναι 0,24 nm και η ενέργεια διάσπασής του (ίση με την ενέργεια που κερδίζεται κατά το σχηματισμό του μορίου) είναι 4,2 eV.
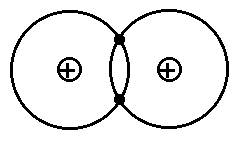
Στον ομοιοπολικό δεσμό δεν έχουμε προσχώρηση των ηλεκτρονίων σθένους από το ένα άτομο στο άλλο, αλλά έχουμε μάλλον μοίρασμα των ηλεκτρονίων μεταξύ των ατόμων (κοινοκτημοσύνη). Τα ηλεκτρόνια, π.χ. σε ένα διατομικό μόριο, έλκονται ταυτόχρονα από τους πυρήνες και των δύο ατόμων και αυτή η έλξη είναι που κρατάει τα άτομα ενωμένα. Το γεγονός ότι τα ηλεκτρόνια αξιοποιούν την έλξη και των δύο πυρήνων ταυτόχρονα κάνει το μόριο είναι ενεργειακά συμφερότερη κατάσταση (περισσότερη έλξη > περισσότερο αρνητική (χαμηλότερη) ενέργεια). Παράδειγμα ομοιοπολικού δεσμού είναι ο δεσμός μεταξύ όμοιων ατόμων, π.χ. στο μόριο H2, βλ. Σχ. 2.
Για την καλύτερη κατανόηση του ομοιοπολικού
δεσμού κοιτάτε και το επόμενο εδάφιο, Κβαντομηχανική
περιγραφή του χημικού δεσμού
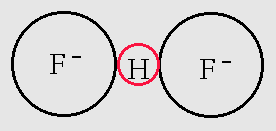
Ο δεσμός Υδρογόνου είναι εξαιρετικά ασθενής αλλά με πολύ μεγάλη βιολογική σημασία, επειδή είναι ο δεσμός που συνδέει τμήματα πολύ βασικών βιολογικών μορίων (π.χ. στο DNA τις στροφές της έλικας). Στο δεσμό Υδρογόνου δύο αρνητικά ιόντα κρατιούνται ενωμένα μέσω της έλξης και των δύο με το πρωτόνιο του ατόμου του Η. Π.χ. στο ιόν του HF2-, βλ. Σχ. 3.
Οι δεσμοί Van der Waals είναι ασθενέστεροι από όλους τους παραπάνω δεσμούς. Είναι κυρίως δεσμοί μεταξύ μορίων (ή ατόμων που δεν συνδέονται με ιοντικούς ή ομοιοπολικούς δεσμούς) για το σχηματισμό της στερεάς, υγρής ή αέριας ύλης. Οφείλονται στις αδύναμες ηλεκτροστατικές έλξεις ανάμεσα στα ουδέτερα αυτά μόρια. Οι δυνάμεις Van der Waals είναι τριών ειδών:
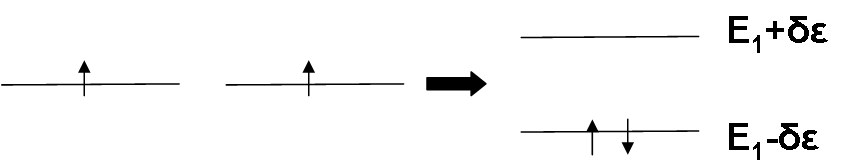
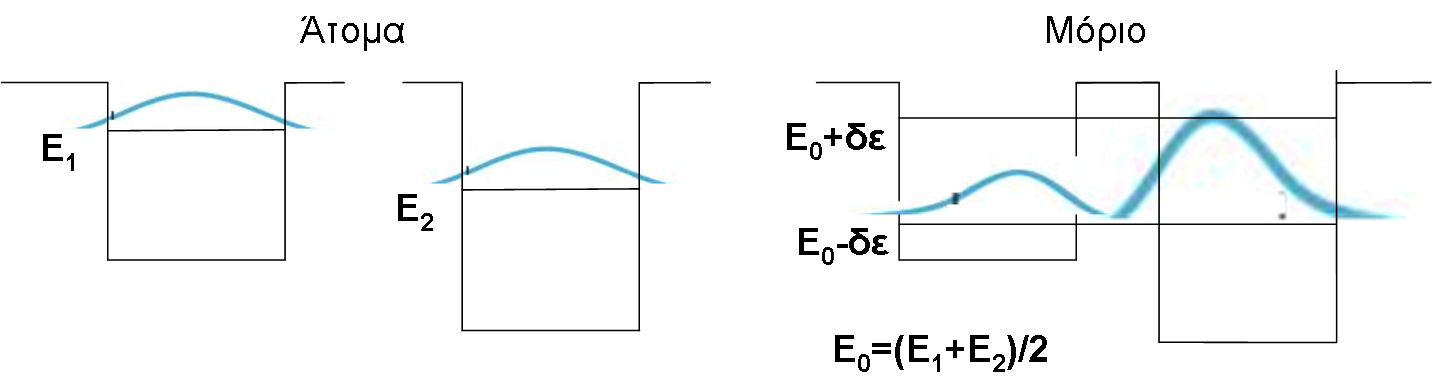
Κατά το σχηματισμό του Η2 δύο πηγάδια δυναμικού έρχονται κοντά το ένα στο άλλο. Στην περίπτωση αυτή δίδεται η δυνατότητα στα ηλεκτρόνια του ενός ατόμου να μεταπηδήσουν και στο άλλο άτομο (γιατί;). Η επιπλέον ηλεκτροστατική έλξη που δέχονται τα ηλεκτρόνια του κάθε ατόμου από το δεύτερο άτομο έχει ως αποτέλεσμα την τροποποίηση του δυναμικού του συστήματος και άρα και των ενεργειακών του καταστάσεων, σε σχέση με τις καταστάσεις των δύο μεμονωμένων ατόμων. Η τροποποίηση αυτή φαίνεται στο Σχ. 4.

Οι δύο νέες καταστάσεις (μοριακές στάθμες) που προκύπτουν από τις στάθμες Ε1 (Σχ. 4) έχουν ενέργεια Ε1-δΕ και Ε1+δΕ, όπου το δΕ (θετικό) είναι τόσο μεγαλύτερο όσο μεγαλύτερη είναι η δυνατότητα μεταπήδησης του ηλεκτρονίου από το ένα άτομο στο άλλο (ή, πιο μαθηματικά, όσο μεγαλύτερη είναι η επικάλυψη των κυματοσυναρτήσεων των δύο ατομικών σταθμών, για τη δεδομένη απόσταση των ατόμων).
Ο εποικισμός των μοριακών σταθμών από τα ηλεκτρόνια των ατόμων γίνεται και εδώ χρησιμοποιώντας την αρχή του Pauli. Στο Σχ. 5 φαίνεται ο εποικισμός αυτός για το μόριο του Η2.
Εν γένει, σε ένα μόριο, από κάθε ατομική στάθμη προκύπτουν τόσες μοριακές στάθμες όσος είναι και ο αριθμός των ατόμων που αποτελούν το μόριο. Η κατάληψη των σταθμών γίνεται με βάση την αρχή του Pauli. Όταν η προκύπτουσα κατάσταση δεν συμφέρει ενεργειακά τα άτομα δεν σχηματίζουν μόριο.
---------
Χρησιμοποιώντας τα παραπάνω εξηγήστε γιατί τα εσωτερικά
ηλεκτρόνια των ατόμων δεν παίζουν ρόλο στο σχηματισμό μορίων.
Εξηγήστε γιατί
τα ευγενή αέρια δεν σχηματίζουν μόρια.
Χρησιμοποιήστε την αρχή της
αβεβαιότητας για να εξηγήσετε γιατί συμφέρει ενεργειακά το κάθε ηλεκτρόνιο του
μορίου να "χρησιμοποιεί" και τα δύο άτομα.
Με βάση αυτά που είχαμε πει στο
φαινόμενο σήραγγας εξηγήστε γιατί όταν δύο άτομα έλθουν κοντά τα ηλεκτρόνιά τους
μπορούν να μεταπηδούν από το ένα στο άλλο.
--------
Στο μόριο του Η2 έχουμε τη συνένωση δύο όμοιων ατόμων, δηλαδή δύο όμοιων πηγαδιών δυναμικού. Στην περίπτωση αυτή έχουμε ίση πιθανότητα να βρούμε το κάθε ηλεκτρόνιο σθένους κοντά στο ένα ή το άλλο άτομο και άρα το μόριό μας είναι μη πολικό, δηλαδή το κέντρο "βάρους" τόσο του αρνητικού όσο και του θετικού φορτίου είναι στο κέντρο του μορίου. Ο δεσμός στην περίπτωση αυτή είναι ομοιοπολικός, γιατί τα ηλεκτρόνια σθένους τα "μοιράζονται εξίσου" και τα δύο άτομα.
Στις περιπτώσεις όπου το μόριο αποτελείται από ανόμοια άτομα έχουμε συνένωση δύο πηγαδιών δυναμικού διαφορετικού βάθους. Στην περίπτωση αυτή, βλ. Σχ. 6, τα ηλεκτρόνια θα έχουν την τάση να περνούν τον περισσότερο χρόνο της ζωής τους κοντά στο βαθύτερο πηγάδι (στο ισχυρότερο ελκτικό κέντρο). Ως αποτέλεσμα θα έχουμε ένα πολικό μόριο (ανομοιόμορφη κατανομή φορτίου στον όγκο του μορίου, αφού τα ηλεκτρόνια σθένους θα βρίσκονται κατά το πλείστον στη γειτονιά του βαθύτερου πηγαδιού, αφήνοντας το πιο ρηχό πηγάδι με περίσσεια θετικού φορτίου). Ο δεσμός στην περίπτωση αυτή είναι κυρίως ετεροπολικός.
---------
Αναλύστε κβαντομηχανικά τη δομή του μορίου του νερού
(H2O) και εξηγήστε το τριγωνικό σχήμα του, την ικανότητά του να
διαλύει τις πολικές ενώσεις (π.χ. αλάτι), τη μεγάλη θερμοχωρητικότητά του και το
γεγονός ότι ο πάγος επιπλέει στο νερό.
----------
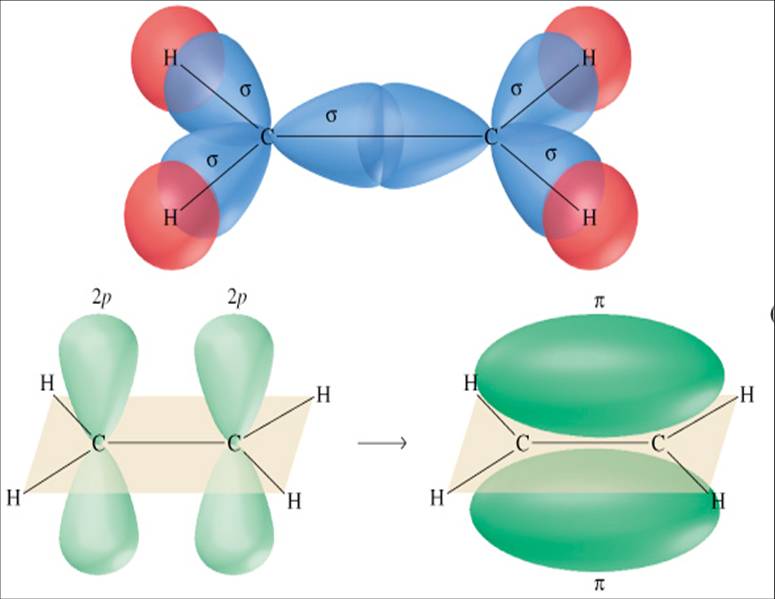
Όσον αφορά τώρα τη μορφή των μοριακών κυματοσυναρτήσεων στο χώρο: Αν οι ατομικές καταστάσεις που "ενώνονται" για να σχηματίσουν τον χημικό δεσμό (ατομικά τροχιακά σθένους) είναι καταστάσεις τύπου s, ή καταστάσεις τύπου p που ενώνονται όπως φαίνεται στο πάνω από τα Σχ. 7 (μετωπικά), η προκύπτουσα κατάσταση έχει συμμετρία περιστροφής γύρω από τον άξονα του μορίου. Ένας τέτοιος δεσμός λέγεται τύπου σ και είναι εξαιρετικά ισχυρός. Αν τα ατομικά τροχιακά σθένους ενώνονται "πλευρικά", δηλ. όπως στο κάτω από τα Σχ. 7, ο δεσμός είναι ασθενέστερος και λέγεται τύπου π.
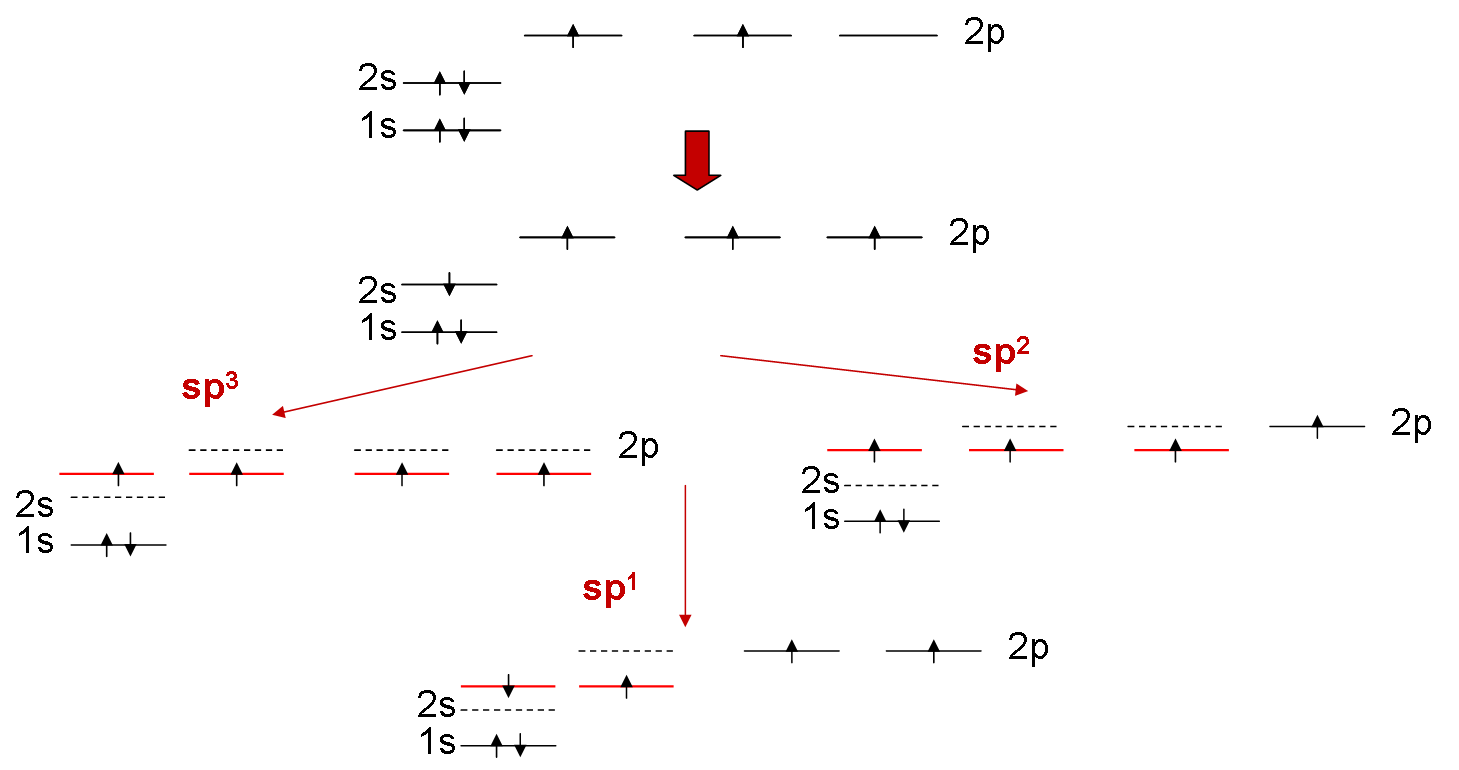
Μια άλλη έννοια που συμπληρώνει και επεκτείνει την παραπάνω κβαντομηχανική περιγραφή του δεσμού και που εξηγεί τη δομή, τη γεωμετρία και τις ενέργειες των οργανικών (κυρίως) μορίων είναι η έννοια του υβριδισμού. Υβριδισμός είναι η "τροποποίηση" (ανάμιξη) των ατομικών τροχιακών των ατόμων που συμμετέχουν στον χημικό δεσμό προκειμένου να αξιοποιήσουν καλύτερα την ένωσή τους με το άλλο άτομο (ή τα άλλα άτομα). Τα τροποποιημένα αυτά ατομικά τροχιακά (υβριδικά τροχιακά) αλληλεπιδρούν ισχυρότερα (αλληλοεπικαλύπτονται περισσότερο) κατά το σχηματισμό μορίου, με αποτέλεσμα η προκύπτουσα κατάσταση (μόριο) να έχει χαμηλότερη ενέργεια. Ο υβριδισμός εμφανίζεται κυρίως στον άνθρακα (Ζ=6) και ερμηνεύει τη μεγάλη ποικιλία των δεσμών του.
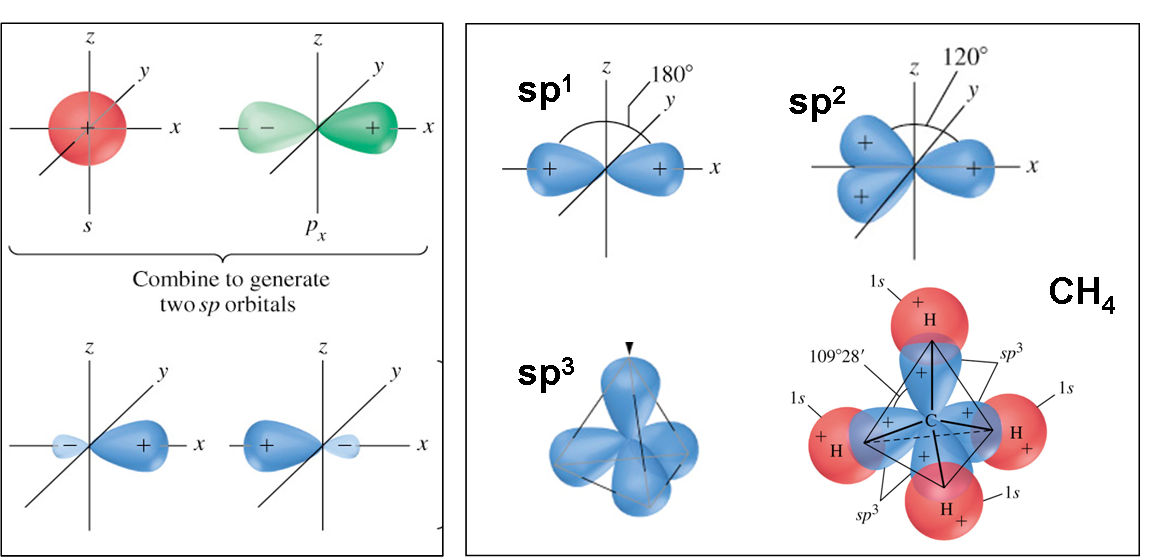
Τα υβριδικά τροχιακά προκύπτουν από "ανάμιξη" (γραμμικό συνδυασμό των κυματοσυναρτήσεων) των τροχιακών τύπου s και τύπου p. Η διαδικασία αυτή για τον άνθρακα δείχνεται στο Σχ. 8 και η μορφή των υβριδικών τροχιακών στο Σχ. 9.
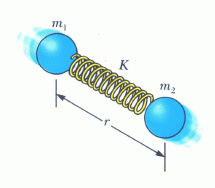
Όταν σε ένα μόριο (το οποίο δεν κινείται ως σύνολο) δίδεται ενέργεια, η ενέργεια αυτή μπορεί να χρησιμοποιηθεί είτε για να διεγείρει τα ηλεκτρόνιά του, φέρνοντάς τα σε υψηλότερες στάθμες, είτε για να το περιστρέψει (Σχ. 10 - αριστερά), είτε για να το θέσει σε ταλάντωση (Σχ. 10 - δεξιά), δηλαδή για να του αλλάξει είτε ηλεκτρονική, είτε περιστροφική, είτε ταλαντωτική κατάσταση).
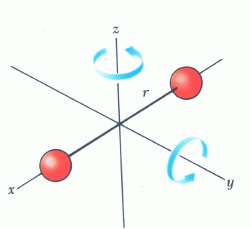
Όπως είδαμε πιο πάνω, οι ηλεκτρονικές καταστάσεις των μορίων, οι οποίες προκύπτουν από τις αντίστοιχες ατομικές, είναι κβαντισμένες. Οι ηλεκτρονικές ενέργειες είναι της τάξης των μερικών eV και έτσι τα μόρια σε συνήθεις θερμοκρασίες βρίσκονται στη θεμελιώδη στάθμη τους (γιατί;). Στα επόμενα θα εξετάσουμε τις περιστροφικές και τις ταλαντωτικές ενέργειες και θα δείξουμε ότι είναι επίσης κβαντισμένες.
Μοριακή περιστροφή: Η κβάντωση των περιστροφικών ενεργειών απορρέει από την κβάντωση της στροφορμής, σε συνδυασμό με τη σχέση ενέργειας-στροφορμής:
Η μετάβαση του μορίου από τη μια περιστροφική κατάσταση στην άλλη γίνεται
υπακούοντας στον κανόνα επιλογής ![]() (γιατί;).
(γιατί;).
Η τάξη μεγέθους των περιστροφικών ενεργειών (δηλαδή των ενεργειών των φωτονίων που προέρχονται από μεταβολές της περιστροφικής κατάστασης του μορίου, ή αλλιώς από μεταπτώσεις μεταξύ περιστροφικών επιπέδων) είναι
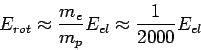 (4).
(4).
Μοριακή ταλάντωση: Στο σύστημα κέντρου μάζας ένα διατομικό μόριο, όσον
αφορά την ταλαντωτική του συμπεριφορά, μπορεί να περιγραφεί ως ένα σωμάτιο μάζας
μ που κινείται στο δυναμικό του σχήματος 1 (εκτελεί μικρές ταλαντώσεις γύρω από
το ελάχιστο του δυναμικού, όπου ![]() , r είναι η απόσταση των
ατόμων). (Αποδείξτε το.) Πρόκειται δηλαδή για έναν μονοδιάσταστο ταλαντωτή μάζας μ και σταθεράς ελατηρίου
, r είναι η απόσταση των
ατόμων). (Αποδείξτε το.) Πρόκειται δηλαδή για έναν μονοδιάσταστο ταλαντωτή μάζας μ και σταθεράς ελατηρίου ![]() . (Η σταθερά k εξαρτάται από την ισχύ του ηλεκτροστατικής φύσης μοριακού δεσμού.)
. (Η σταθερά k εξαρτάται από την ισχύ του ηλεκτροστατικής φύσης μοριακού δεσμού.)
Ένας τέτοιος ταλαντωτής, όπως έχουμε δει σε προηγούμενα κεφάλαια έχει διακριτό φάσμα, και οι δυνατές ενέργειές του δίδονται από
Σημειώστε ότι ακόμα και στη χαμηλότερη ταλαντωτική κατάσταση, ν=0, το μόριο δεν ηρεμεί. Η ενέργεια της κατάστασης αυτής λέγεται ενέργεια μηδενικού σημείου.
Για τις μεταβάσεις μεταξύ ταλαντωτικών καταστάσεων ισχύει ο κανόνας επιλογής
![]() .
.
Η τάξη μεγέθους των ταλαντωτικών ενεργειών (ενέργειες από μεταπτώσεις μεταξύ ταλαντωτικών επιπέδων, ή, ισοδύναμα, αλλαγές στην ταλαντωτική κατάσταση του μορίου) είναι
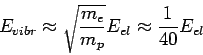 (6).
(6).
-------
Αποδείξτε το πρώτο μέλος της (2).
Αποδείξτε την (3), την (4)
και την (6).
-------
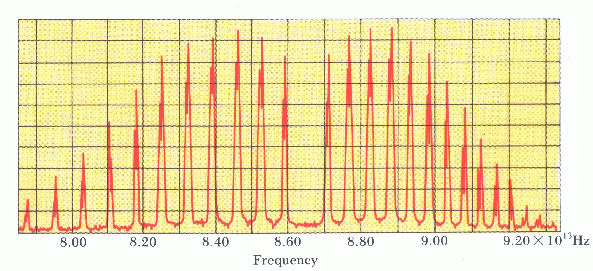
Με τον όρο μοριακό φάσμα εννοούμε το σύνολο των συχνοτήτων των φωτονίων που εκπέμπονται κατά τις μεταβάσεις του μορίου από μια κατάσταση σε άλλη. Επειδή στις συνηθισμένες θερμοκρασίες τα ηλεκτρόνια του μορίου είναι "παγωμένα" στη θεμελιώδη τους κατάσταση, οι μεταβάσεις που συνήθως γίνονται θα είναι μεταξύ περιστροφικών και ταλαντωτικών καταστάσεων.
Από τη σχέση που δίνει τις ταλαντωτικές και περιστροφικές επιτρεπτές ενεργειες,
Τα φωτόνια των μοριακών φασμάτων εκπομπής τα οποία προέρχονται από μεταπτώσεις μεταξύ ταλαντωτικών και περιστροφικών καταστάσεων θα έχουν ενέργειες
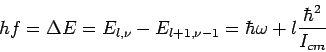 (l=1,2,..),
(l=1,2,..),
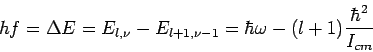 (l=0,1,2,..).
(l=0,1,2,..).
----------
Σχεδιάστε τις πρώτες περιστροφικές και ταλαντωτικές στάθμες
διατομικού μορίου και δείξτε με βέλη τις επιτρεπτές αποδιεγέρσεις του
μορίου.